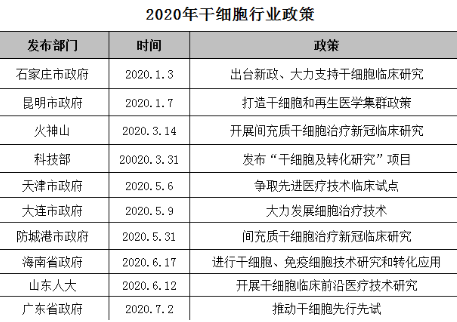
从2020年1月到现在,国家以及地方政府相继发文支持干细胞转化及产业化进程。本文对今年以来颁布的新政策进行汇总,且详细介绍了近三个月的,帮助大家从政策层面了解干细胞行业的发展趋势。
七月
《免疫细胞治疗产品临床试验技术指导原则(征求意见稿)》
2020年7月6日,国家药品监督管理局药品审评中心发布《免疫细胞治疗产品临床试验技术指导原则(征求意见稿)》,以期为药品研发注册申请人及开展药物临床试验的研究者提供更具针对性的建议和指南。

本指导原则的内容适用于按照药品管理相关法规进行研发和注册申报的细胞免疫治疗产品,旨在为该类产品开展临床试验的总体规划、设计、实施和试验数据分析等方面提供必要的技术指导,以减少受试者参加临床试验的风险,并规范对细胞免疫治疗产品的安全性和有效性的评价方法。
八月
《南京市打造新医药与生命健康产业地标行动计划》
8月12日,南京市人民政府办公厅发布《南京市打造新医药与生命健康产业地标行动计划》。总的思路是协调推动医药(生物医药)、医疗(医疗服务)、医工(医疗器械)、医信(医疗信息)、医养(康复养老)、医体(体育健康)联动发展,进一步完善产业图谱,明晰发展方向和重点,加快构建相对完善、具有独特竞争力的产业链。

提出发展细胞与基因产业,重点发展细胞存储、细胞技术研发、免疫细胞治疗、干细胞治疗,基因测序、基因编辑、基因工程药物、基因治疗、基因芯片、基因大数据等。加快建设从细胞存储、核心试剂和细胞培养基产品开发、临床研究到实际应用全产业链条。打通细胞治疗上下游产业链,形成产业闭环,实现企业与企业、企业与医院、企业与科研机构的双向合作,推动细胞治疗快速产业化。

《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(征求意见稿)》
8月4日,国家药品监督管理局药品审评中心组织起草了《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(征求意见稿)》,以期为药品研发注册申请人及开展药物临床试验的研究者提供更具针对性的建议和指南。
本指导原则适用于按照《药品管理法》、《药品注册管理办法》等药品管理相关法规进行研发和注册申报的干细胞相关产品,旨在为该类产品开展临床试验的总体规划、设计、实施和试验数据分析等方面提供必要的技术指导,规范药物临床试验申办者(以下简称申办者)和临床试验研究者对干细胞相关产品的安全性和有效性的评价方法,并最大程度地保护受试者参加临床试验的安全和权益。
九月
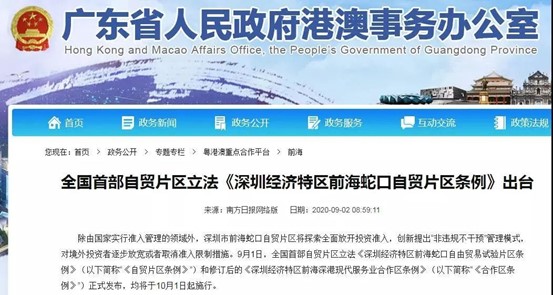
《深圳经济特区前海蛇口自由贸易试验片区条例》
9月1日,全国首部自贸片区立法《深圳经济特区前海蛇口自由贸易试验片区条例》(以下简称“《自贸片区条例》”)和修订后的《深圳经济特区前海深港现代服务业合作区条例》(以下简称“《合作区条例》”)正式发布,均将于10月1日起施行。
《自贸片区条例》第五十一条明确:自贸片区内医疗机构和科研机构可以根据自身的技术能力,按照有关规定开展干细胞、免疫细胞、基因治疗以及单抗药物、组织工程等新技术研究和转化应用。
根据全球知名调研机构Technavio发布的报告,全球干细胞治疗市场有望在2020年至2024年间增长5.8亿美元左右,预计将以7%的复合年增长率增长。报告指出,推动全球干细胞治疗市场增长的重要因素是人们对干细胞治疗的认识不断提高。中上游:干细胞存储市场复合年增长率近10%;下游:干细胞的临床需求持续增加;全产业:全球市值将达2700亿美元。全球干细胞市场包括上中游的干细胞存储制备以及下游的临床应用。到2025年底,全球干细胞市场规模预计达到2705亿美元,近8年全球干细胞市场的复合年增长率有望达到13.8%。
美国《科学》杂志曾将干细胞研究评为世界十大科学成就之首。2020年,在全球抗击新冠肺炎的临床探索中,干细胞取得了良好的疗效,也助推干细胞行业更快的发展。
 关注官方微信
关注官方微信